
今日記者從河南省藥監局獲悉,7月23日,國家藥監局發布了關于25批次藥品不符合規定的通告,有14家藥品生產企業生產的25批次藥品不符合規定。
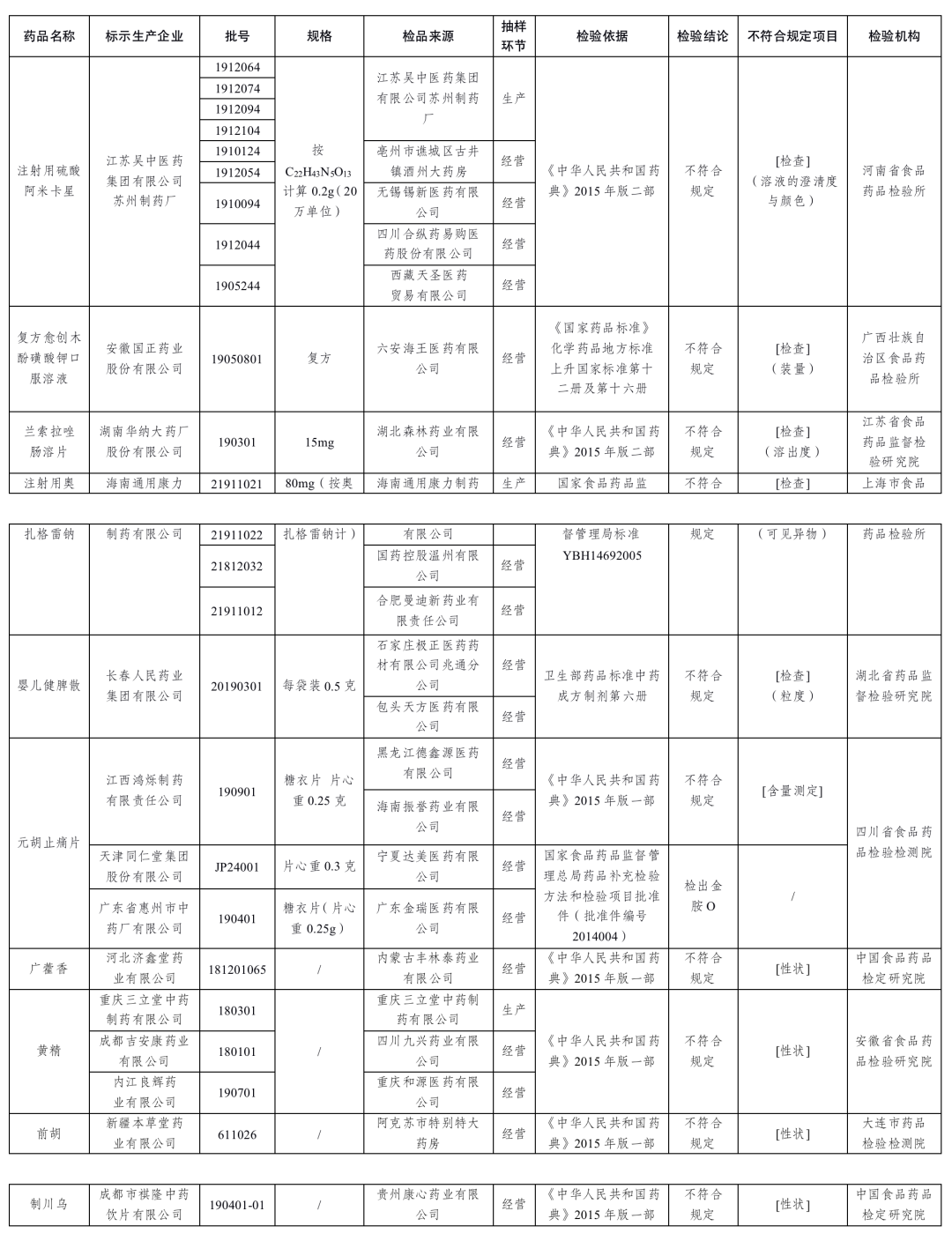
經河南省食品藥品檢驗所等9家藥品檢驗機構檢驗,標示為江蘇吳中醫藥集團有限公司蘇州制藥廠等14家藥品生產企業生產的25批次藥品不符合規定。
1.經河南省食品藥品檢驗所檢驗,標示為江蘇吳中醫藥集團有限公司蘇州制藥廠生產的9批次注射用硫酸阿米卡星不符合規定,不符合規定項目為溶液的澄清度與顏色。
2.經廣西壯族自治區食品藥品檢驗所檢驗,標示為安徽國正藥業股份有限公司生產的1批次復方愈創木酚磺酸鉀口服溶液不符合規定,不符合規定項目為裝量。
3.經江蘇省食品藥品監督檢驗研究院檢驗,標示為湖南華納大藥廠股份有限公司生產的1批次蘭索拉唑腸溶片不符合規定,不符合規定項目為溶出度。
4.經上海市食品藥品檢驗所檢驗,標示為海南通用康力制藥有限公司生產的4批次注射用奧扎格雷鈉不符合規定,不符合規定項目為可見異物。
5.經湖北省藥品監督檢驗研究院檢驗,標示為長春人民藥業集團有限公司生產的1批次嬰兒健脾散不符合規定,不符合規定項目為粒度。
6.經四川省食品藥品檢驗檢測院檢驗,標示為江西鴻爍制藥有限責任公司生產的1批次元胡止痛片不符合規定,不符合規定項目為含量測定;標示為天津同仁堂集團股份有限公司、廣東省惠州市中藥廠有限公司生產的2批次元胡止痛片檢出金胺O。
7.經中國食品藥品檢定研究院檢驗,標示為河北濟鑫堂藥業有限公司生產的1批次廣藿香不符合規定,不符合規定項目為性狀。
8.經安徽省食品藥品檢驗研究院檢驗,標示為重慶三立堂中藥制藥有限公司、成都吉安康藥業有限公司、內江良輝藥業有限公司生產的3批次黃精不符合規定,不符合規定項目為性狀。
9.經大連市藥品檢驗檢測院檢驗,標示為新疆本草堂藥業有限公司生產的1批次前胡不符合規定,不符合規定項目為性狀。
10.經中國食品藥品檢定研究院檢驗,標示為成都市祺隆中藥飲片有限公司生產的1批次制川烏不符合規定,不符合規定項目為性狀。
對上述不符合規定藥品,藥品監督管理部門已要求相關企業和單位采取暫停銷售使用、召回等風險控制措施,對不符合規定原因開展調查并切實進行整改。
國家藥品監督管理局要求相關省級藥品監督管理部門依據《中華人民共和國藥品管理法》,組織對上述企業和單位生產銷售假劣藥品的違法行為立案調查,并按規定公開查處結果。
鄭報全媒體記者 李愛琴
